La Reproducción Asistida comienza en el laboratorio. Esta es la historia de la Reproducción Asistida: mi historia.
Una de las cosas buenas que nos da la edad es la perspectiva. Hace más de treinta años que trabajo en el laboratorio de Reproducción Humana. Y pienso en la consabida frase hecha “cómo pasa el tiempo…”. Es verdad, ha pasado muy rápido, pero, sobre todo, si hago memoria sobre cómo era el laboratorio antes y cómo es ahora, parece que todavía han transcurrido más años.

Noticia del nacimiento de Louise Brown
El 25 de julio de 1978 nacía Louise Joy Brown, la llamada primer ‘bebé probeta’, el primer nacimiento obtenido por fecundación in vitro. Y lo que ahora se considera un tratamiento de rutina en las parejas con problemas de fertilidad, hace cuarenta años supuso una auténtica revolución. Tanto fue así, que relegaron a un rincón del hospital el laboratorio de Fecundación in vitro donde se consiguió el primer nacimiento de FIV. Y la sociedad entonces era un fiel reflejo de lo que ocurría dentro de los laboratorios.
Además de sus padres, los protagonistas de aquella jornada fueron el fisiólogo Robert Edwards, el ginecólogo Patrick Steptoe y la bióloga Jean Purdy. A pesar del escepticismo generalizado entre sus colegas, la oposición de la Iglesia y algunos gobiernos, lo consiguieron. En 2010, se les reconoció con el premio Nobel de Medicina.
Unos años después, en 1984, nacía la primera niña por fecundación in vitro en España, gracias al equipo del Instituto Dexeus, cuya directora de laboratorio era Anna Veiga. Al año siguiente, en 1985, me incorporé al mundo de la Reproducción Humana Asistida ya que pensé que, en ambos casos, la clave del éxito fue contar con espléndidos biólogos que hicieran posible, primero la fecundación del óvulo fuera del organismo, y luego su desarrollo embrionario en el laboratorio. Y eso es lo que yo quería lograr.
Cuando leí la noticia del nacimiento de Louise Brown, me maravilló lo que se había conseguido. Pero mentiría si dijera que ya tenía claro cuál sería mi futuro en la Biología. No hasta ese momento. Pero como ocurre en muchas ocasiones en la vida, la casualidad, unida a la perseverancia, dirigen nuestro destino. Mi ideal sí estaba perfectamente definido: quería trabajar en un hospital, investigando. Por eso, cuando acabé los estudios de Biología, recorrí todos y cada uno de los hospitales madrileños en busca de un laboratorio que me dejara aprender. Hasta que, en el Ramón y Cajal, el que más tarde sería mi jefe, me dio la oportunidad de quedarme como asistente voluntario. Y quiso la suerte que en ese hospital naciera la primera niña por fecundación in vitro en Madrid.
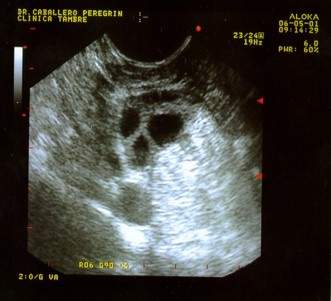
Ecografía vaginal donde se ven los folículos en los ovarios
La teoría era muy sencilla: se extraen de los ovarios uno o varios óvulos (ovocitos) y se colocan en un medio de cultivo adecuado en el laboratorio. Allí, en contacto con los espermatozoides de su pareja, fecundan ellos solos, lo que hay que comprobar entre las 16 y las 18 horas. Eso es la fecundación “in vitro” convencional. Posteriormente, hay que esperar al menos 48 horas para que los ovocitos fecundados se dividan. Cuando alcanzan el estadio adecuado: cuatro u ocho células, se transfieren al útero materno, donde continuarán su desarrollo.
Sin embargo, en esos comienzos, en la práctica, se encontraban muchos problemas: los óvulos no fecundaban, o no se desarrollaban adecuadamente y paraban su división… Y en el laboratorio había que investigar por qué ocurría aquello.
Cuando empecé a trabajar o, mejor dicho, a aprender, en el Ramón y Cajal, me di cuenta de que ese tratamiento de fecundación in vitro fue un hecho aislado en el hospital, algo fortuito, y que sería muy difícil que allí se instaurara un departamento de Reproducción Asistida con todo lo necesario: quirófano, con su anestesista y enfermeras, y todos los aparatos necesarios para llevarlo a cabo.

Noticia del nacimiento de la primera niña de FIV en España
En los años 80, la extracción de los óvulos no se hacía como ahora, por vía vaginal y ecografía, sino que era necesario una intervención quirúrgica: una laparoscopia, realizada por vía abdominal. Aquello representaba la necesidad de contar con una serie de medios tanto humanos como de equipamiento, difíciles de conseguir en un hospital público. Únicamente estábamos mi jefe, ginecólogo, otra persona en el laboratorio y yo.
Sin embargo, no me desanimé. La Reproducción Humana Asistida abarca un campo muy extenso, y me dediqué de lleno a estudiar el factor masculino, es decir, los espermatozoides. En el hospital se realizaban entonces inseminaciones artificiales, para lo cual tenía que preparar en el laboratorio la muestra de semen, dejando solo los mejores espermatozoides, que el ginecólogo introducía en el útero de la paciente. El problema era que los varones con pocos espermatozoides o en el caso de que estos tuvieran una movilidad baja, no tenían apenas posibilidades de llegar al óvulo y fecundarlo. Teníamos que intentar mejorar esas muestras de semen y aumentar así las posibilidades de éxito.
Allí aprendí, no solo a preparar esas muestras y conocer por qué en muchos casos, existían problemas en el varón. También me sirvió la experiencia para “llegar a acuerdos” con laboratorios farmacéuticos, con los que llevábamos a cabo trabajos de investigación para lo cual me dejaban equipos con los que poder trabajar. Gracias a ellos, también, pude hacer una estancia en un hospital de Filadelfia para aumentar mis conocimientos en ese tema y aprender más de fecundación in vitro.
También supe que en el hospital había muchos pacientes jóvenes con problemas, como el cáncer, que afectarían en el futuro a su capacidad reproductiva, pero que podríamos solucionar si congelábamos sus espermatozoides. Y así establecimos un banco de semen para pacientes oncológicos, sin ningún apoyo institucional, que servía de ayuda a muchos varones con posibilidad de cura.
Los primeros tiempos en el laboratorio
Tras cuatro años de trabajo no remunerado en el hospital, por fin, en el año 89, mi jefe consiguió que me hicieran un contrato, y entré a formar parte del servicio de Ginecología.
Cuando regresé de Estados Unidos, pensé en lo útil que sería todo lo aprendido para aplicarlo en la Reproducción Humana Asistida. En los años 80 se desarrollaron técnicas de congelación que permitían conservar los embriones sobrantes para un posible uso futuro, evitando tener que volver a extraer óvulos. También comenzaron a utilizarse procedimientos poco invasivos basados en ultrasonidos para obtener dichos óvulos, en lugar de tener que practicar una incisión abdominal. Poco tiempo después, en los 90, se idearon métodos como la inyección intracitoplasmática o ICSI, mediante la cual se inyecta directamente un espermatozoide, que incluso puede ser seleccionado específicamente, en el óvulo. De este modo se puede conseguir una fecundación con éxito cuando el recuento de espermatozoides del varón es muy bajo o cuando estos tienen dificultades para acceder al óvulo.
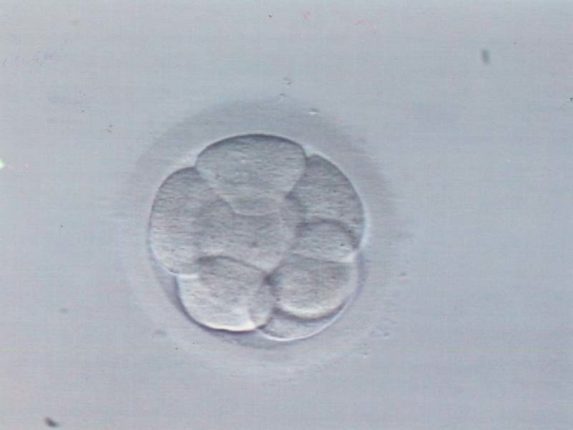
Embrión de 8 células
Sin embargo, las trabas burocráticas y la falta de medios seguían siendo un problema para poder realizar estas técnicas en el hospital. Pude finalizar mi tesis doctoral estudiando la influencia de las infecciones en los espermatozoides, pero no podíamos atender todos los casos de infertilidad que se presentaban. No podíamos quedarnos parados únicamente realizando inseminaciones a las pacientes. Así que, tras varios años de vanos intentos, mi jefe y yo tomamos la decisión de dar el gran salto, dejando la medicina pública para empezar a trabajar en un centro privado. Fue una dura decisión, porque mi trabajo en el hospital me apasionaba. No era el clásico trabajo de un biólogo encerrado todo el día en un laboratorio haciendo experimentos. Hablaba con los pacientes, conocía sus problemas e intentaba, con cada uno de ellos, tratar sus “muestras” como si fueran únicas. Quería que pudieran conseguir su sueño. En muchos casos lo conseguíamos, y era la mayor recompensa que pudiéramos tener. Pero muchos otros tenían que recurrir a otras técnicas de las que no disponíamos para solucionar su infertilidad.
Por otra parte, en este trabajo no se descansa nunca. No hay fines de semana, ni fiestas, ni siquiera las de Navidad o Reyes, siempre hay pacientes que tienen que hacerse una punción ovárica cualquiera de estos días, si coincide con el momento de la ovulación. Bien es cierto que existe la posibilidad de intentar programar los tratamientos para que no coincidan con fechas como estas. Pero no es la manera de hacer las cosas. Ya que no queda más remedio que estimular a los ovarios con hormonas, inducir la ovulación de forma artificial, y conseguir extraer los ovocitos por medio de una punción ovárica, tenemos que dejar algo a la naturaleza. E intentar forzar el día de la punción conlleva que los resultados no son los más adecuados: en cuanto al número de folículos, la calidad de los ovocitos y, al fin, la consecución del embarazo. Y la medicina pública no contempla esto.

Placa de cultivo donde se colocan los ovocitos y/o los embriones
Trabajar en el laboratorio de Embriología me abrió los ojos a un mundo nuevo. Los principios fueron duros. Por ejemplo, teníamos que fabricarnos nosotros mismos los medios de cultivo, los incubadores para los embriones no tenían la calidad necesaria… y todo ello se traducía en que fecundaban pocos óvulos, y las tasas de embarazo no superaban el 15%, cuando hoy en día están por encima del 40% en cada intento.
Microinyectar los ovocitos, coger cada espermatozoide e introducirlo dentro de cada óvulo, es uno de los momentos más estresantes del trabajo del laboratorio. Un mínimo error puede hacer que el óvulo se rompa. O, si hay pocos espermatozoides, puede que no encontremos el adecuado. Después hay que esperar 16 horas para saber si ha fecundado. Llegar al laboratorio al día siguiente con el corazón encogido, mirar el incubador donde están los ovocitos que se microinyectaron…. Comprobar que todo está en orden: temperatura y niveles de los gases de los incubadores, temperatura exterior, etcétera. En definitiva, todos los controles rutinarios diarios. Y casi no atreverme a coger la placa donde están los ovocitos y ponerla en el microscopio. Ese día a día no ha cambiado. Como también hay algo que no ha cambiado: creo que hay pocas cosas en el mundo más fascinantes que ver cómo evoluciona un embrión. Tenemos dos células, un óvulo y un espermatozoide, las “juntamos” en el laboratorio y dos días después del óvulo fecundado aparece milagrosamente ese embrión dividido.

Banco de embriones congelados
Tal vez lo único que pueda superarlo es el crecimiento de un bebé… O quizás no, porque en el laboratorio partimos de una única célula, una célula que puede que no conduzca a nada… o puede que dé origen a una nueva vida.
Cuando después de un tratamiento de fecundación in vitro tenemos en el laboratorio varios embriones que se han dividido, hay que seleccionar el mejor de todos para transferirlo. Y es en esos momentos, estudiando uno por uno al microscopio, cuando siempre se me hacía un nudo en el estómago: ¿estaré eligiendo el mejor? ¿Cuál de ellos será el que tiene más posibilidades de implantar? Y sentía el peso de un enorme compromiso, ya que era responsable de tomar o no la opción correcta.
Bien es cierto que existen características morfológicas embrionarias que nos hacen descartar los que a priori parecen tener pocas posibilidades de éxito: se han dividido poco para el día en que se encuentran, o se han dividido de forma irregular… Pero siempre nos ha surgido la duda cuando contamos con varios embriones similares. Además, esta fase tan sensible del proceso de fecundación in vitro, la elección de los embriones, la hemos realizado invariablemente los embriólogos con más experiencia, con el fin de reducir la subjetividad. Sin embargo, en ocasiones hemos tenido que contrastar las opiniones de varios de nosotros para estar seguros de haberlo realizado correctamente, o bien para poder estandarizar criterios y que todos los embriólogos realicen la selección de la misma forma.

Un laboratorio de FIV en la actualidad
Afortunadamente, en la actualidad contamos en el laboratorio con una nueva tecnología: los sistemas time-lapse, con los que podemos comprobar, no solo día a día, sino a intervalos cortos de tiempo cuál es el embrión que mejor se divide, el que parece que tiene un “buen aspecto” pero que en algún momento de su evolución no se ha comportado correctamente, etcétera.
Cuando era niña me maravillaban los documentales en los que veía cómo se iba dividiendo una flor en mil pétalos, y cómo podías comprobar su evolución en unos minutos. Esa técnica fotográfica es la misma que ahora se aplica para analizar la evolución del crecimiento de los embriones. En el incubador van acopladas varias cámaras fotográficas que realizan captura de imágenes cada cinco minutos. De esta forma, podemos en cualquier momento tener el seguimiento en tiempo real de la división embrionaria.
Y la ayuda que nos presta es enorme. Tanto es así, que su uso ha aumentado el número de pacientes que quedan embarazadas en el primer intento. Y no solo porque podamos conocer la evolución de cada embrión desde el principio al fin del proceso y poder así seleccionar el mejor de ellos, el que el sistema nos ayuda a elegir, también porque las condiciones en las que se mantienen son óptimas: se puede realizar el seguimiento sin sacar los embriones del incubador para observarlos en el microscopio, lo cual mantiene las condiciones de temperatura, que son vitales para la “salud” del embrión.

La autora junto a Ken Daniels, profesor de la Universidad de Canterbury, Nueva Zelanda
El prodigio continúa. Y si antes se me hacía un nudo en el estómago a la hora de elegir el mejor embrión, ahora me ocurre cuando puedo ver cómo ha evolucionado y cómo se ha dividido hasta llegar el momento en que puede implantar…
Los últimos años de la evolución de la fecundación in vitro están marcados por una expansión de las técnicas de genética molecular. De hecho, el diagnóstico de anomalías genéticas en embriones preimplantatorios no es nuevo. El primer caso fue publicado por un grupo de investigadores de Reino Unido en el año 1990, y desde entonces la utilización del diagnóstico genético preimplantacional se ha expandido a casi todos tipos de anomalías genéticas conocidas. Es el futuro.
Se estima que, desde el nacimiento de Louise Brown hace 40 años, unos cinco millones de personas han nacido gracias la fecundación in vitro. En el laboratorio, diariamente, vemos la vida, si no crearse, no voy a ser tan pretenciosa, sí multiplicarse de forma aún incomprensible y maravillosa. Y casi nunca tenemos tiempo de pararnos un momento, y solo pensar, solo contemplar ese milagro constante al alcance de nuestros ojos. Nunca olvidamos a las personas a las que va dirigido ese milagro, los pacientes que acuden a nosotros, como siempre decimos, a que les prestemos ayuda. Siempre están en nuestra mente las atenciones que debemos prestarles, la información que hay que proporcionarles, y siempre, el cariño. Y por supuesto tratando cada una de las células: espermatozoides, ovocitos y embriones, con el máximo cuidado, con una devoción solo propia de nuestra profesión. Pero pensar en el prodigio que cada día nos aguarda, e intentar comprender, eso es más difícil.
 Rocío Núñez Calonge
Rocío Núñez Calonge
Doctora en Biología, especialista en Reproducción Asistida, Máster en Bioética.


